TRNzol Universalreagenz
Merkmale
■ Hohe Flexibilität: Breites Spektrum an Startprobenvolumen, geeignet für die Probenextraktion großer Volumina in einer einzigen Reaktion.
■ Hohe Ausbeute: Fällungsmethode maximiert die Ausbeute an RNA in der Probe.
■ Breiter Einsatz: Geeignet für viele verschiedene Proben wie pflanzliches und tierisches Gewebe, kultivierte Zellen, Blut, Körperflüssigkeiten usw.
■ Schneller Betrieb: Genomische DNA konnte innerhalb von 1 Stunde gewonnen werden.
Spezifikation
Typ: Niederschlagsbasiert
Stichprobe: Viren, Bakterien, Pilze, Tiere, Pflanzengewebe, kultivierte Zellen und Körperflüssigkeiten.
Ziel: RNA
Betriebszeit: ~1 Stunde
Anwendungen: TRNzol Universal Reagenz minimiert die Kontamination von Verunreinigungen wie DNA und Proteinen in der gereinigten Gesamt-RNA und kann direkt für verschiedene molekularbiologische Experimente wie Northern Blot, Dot Blot, PolyA-Screening, In-vitro-Translation, RNase-Schutzanalyse, cDNA-Bibliotheksaufbau verwendet werden , RT-PCR, Echtzeit-PCR und Hochdurchsatz-Sequenzierung.
Alle Produkte können für ODM/OEM angepasst werden. Für Details,Bitte klicken Sie auf kundenspezifischen Service (ODM/OEM)
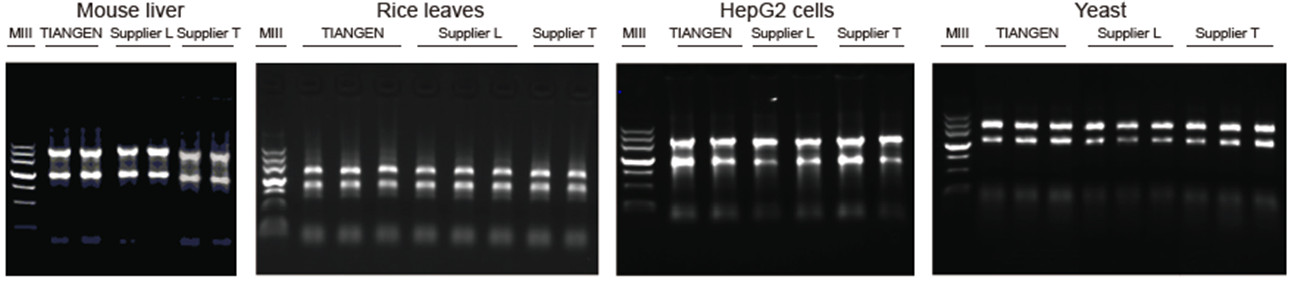
Methode: 30 mg Rattenlebergewebe, 100 mg Reisblätter wurden durch Vermahlen mit flüssigem Stickstoff gesammelt; 1×106HepG2-kultivierte Zellen und 700 ul Saccharomyces Cerevisiae-Kulturmedium (OD600 = 0,9) wurden durch Zentrifugation gesammelt. 1 ml TRNzol Universal Reagent von TIANGEN und die entsprechenden Produkte der Lieferanten L und T wurden zu jedem Probenaliquot gegeben und die RNA-Extraktion wurde gemäß den von jedem Lieferanten bereitgestellten Protokollen durchgeführt. Das Elutionsvolumen betrug 80 µl, 50 µl, 30 µl bzw. 30 µl für die vier Proben. Pro Spur wurden 3 µl des Eluats geladen.
MIII: TIANGEN-Marker III;
Die Elektrophorese wurde 30 min bei 6 V/cm auf einer 1% Agarose durchgeführt.
Ergebnisse: TIANGEN TRNzol Universal Reagent kann hochreine RNA mit guter Integrität aus Rattenleber, Reisblättern, kultivierten Zellen und Hefeproben mit hoher Effizienz extrahieren. Die RNA-Qualität ist vergleichbar oder etwas höher als die von L- und T-Produkten der Anbieter.
A-1 Zelllyse oder Homogenisierung nicht ausreichend
---- Reduzieren Sie den Probenverbrauch, erhöhen Sie die Menge an Lysepuffer, erhöhen Sie die Homogenisierungs- und Lysezeit.
A-2 Probenmenge ist zu groß
---- Verringern Sie die verwendete Probenmenge oder erhöhen Sie die Menge an Lysepuffer.
A-1 Unzureichende Zelllyse oder Homogenisierung
---- Reduzieren Sie den Probenverbrauch, erhöhen Sie die Menge an Lysepuffer, erhöhen Sie die Homogenisierungs- und Lysezeit.
A-2 Probenmenge ist zu groß
----Bitte beachten Sie die maximale Verarbeitungskapazität.
A-3 RNA wird nicht vollständig von der Säule eluiert
---- Nach Zugabe von RNase-freiem Wasser einige Minuten ruhen lassen, bevor zentrifugiert wird.
A-4 Ethanol im Eluenten
---- Nach dem Spülen erneut zentrifugieren und Waschpuffer so weit wie möglich entfernen.
A-5 Zellkulturmedium wird nicht vollständig entfernt
---- Achten Sie beim Sammeln von Zellen darauf, das Kulturmedium so weit wie möglich zu entfernen.
A-6 Die in RNAstore gelagerten Zellen werden nicht effektiv zentrifugiert
---- Die RNAstore-Dichte ist höher als das durchschnittliche Zellkulturmedium; Daher sollte die Zentrifugalkraft erhöht werden. Es wird empfohlen, bei 3000x g zu zentrifugieren.
A-7 Niedriger RNA-Gehalt und -Häufigkeit in der Probe
---- Verwenden Sie eine positive Probe, um festzustellen, ob die geringe Ausbeute durch die Probe verursacht wird.
A-1 Das Material ist nicht frisch
---- Frisches Gewebe sollte sofort in flüssigem Stickstoff aufbewahrt oder sofort in das RNAstore-Reagenz gegeben werden, um den Extraktionseffekt sicherzustellen.
A-2 Probenmenge ist zu groß
---- Probenmenge reduzieren.
A-3 RNase-Kontaminationn
----Obwohl der im Kit enthaltene Puffer keine RNase enthält, kann RNase während des Extraktionsprozesses leicht kontaminiert werden und sollte mit Vorsicht behandelt werden.
A-4 Elektrophorese-Verschmutzung
---- Ersetzen Sie den Elektrophoresepuffer und stellen Sie sicher, dass die Verbrauchsmaterialien und der Ladepuffer frei von RNase-Kontaminationen sind.
A-5 Zu hohe Belastung für Elektrophorese
---- Reduzieren Sie die Menge der Probenbeladung, die Beladung jedes Wells sollte 2 μg nicht überschreiten.
A-1 Probenmenge ist zu groß
---- Probenmenge reduzieren.
A-2 Einige Proben haben einen hohen DNA-Gehalt und können mit DNase behandelt werden.
----Führen Sie eine RNase-freie DNase-Behandlung mit der erhaltenen RNA-Lösung durch, und die RNA kann nach der Behandlung direkt für nachfolgende Experimente verwendet oder durch RNA-Reinigungskits weiter gereinigt werden.
Für Glaswaren, 4 h bei 150°C gebacken. Bei Kunststoffbehältern 10 min in 0,5 M NaOH eingetaucht, dann gründlich mit RNase-freiem Wasser gespült und dann sterilisiert, um RNase vollständig zu entfernen. Die im Experiment verwendeten Reagenzien oder Lösungen, insbesondere Wasser, müssen frei von RNase sein. Verwenden Sie RNase-freies Wasser für alle Reagenzienzubereitungen (Wasser in eine saubere Glasflasche geben, DEPC bis zu einer Endkonzentration von 0,1% (V/V) hinzufügen, über Nacht schütteln und autoklavieren).
Produktkategorien
WARUM UNS WÄHLEN
Seit seiner Gründung entwickelt unsere Fabrik erstklassige Produkte unter Einhaltung des Prinzips
der Qualität zuerst. Unsere Produkte haben einen ausgezeichneten Ruf in der Branche und ein wertvolles Vertrauen bei neuen und alten Kunden gewonnen.